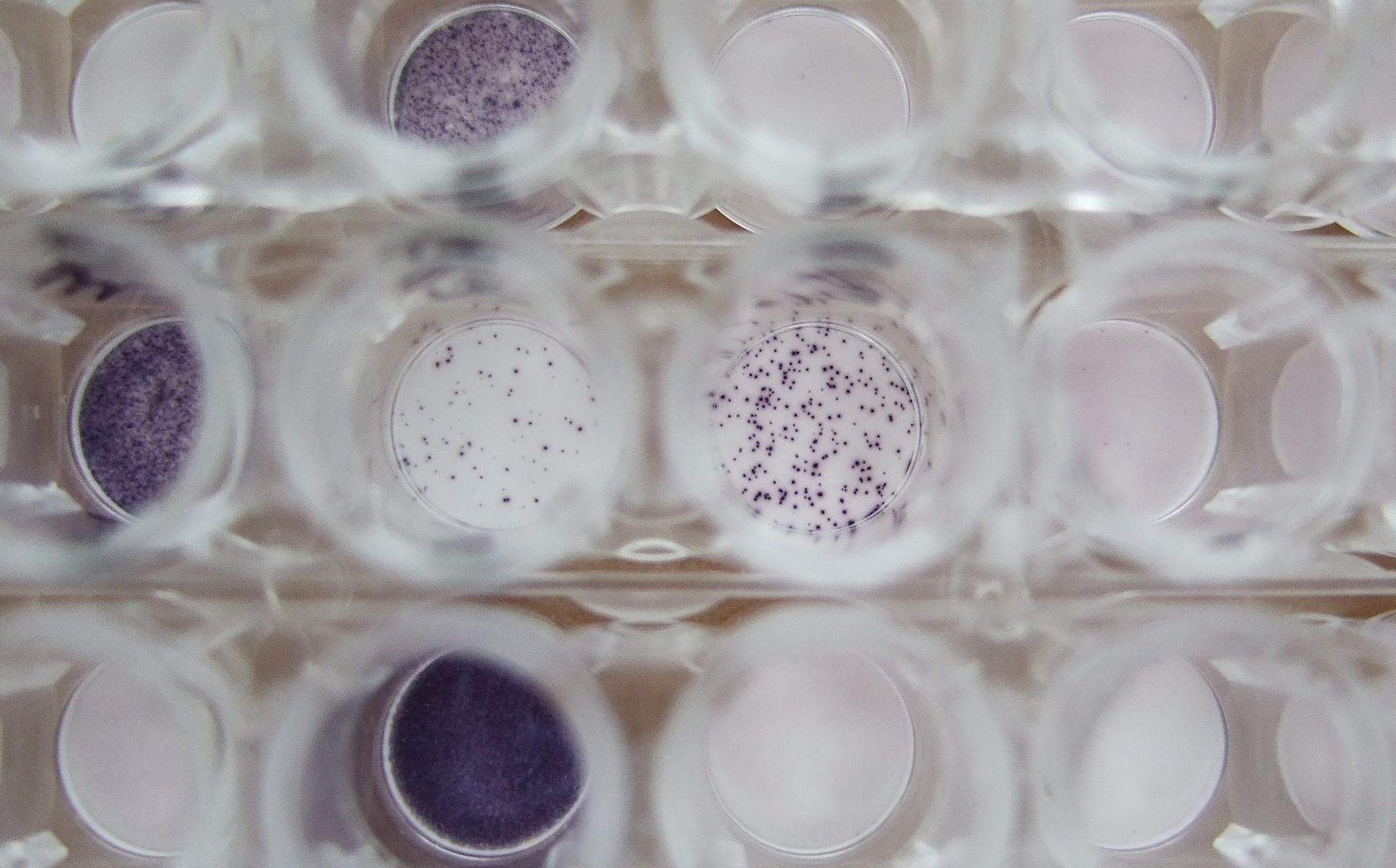
MLC Labor
Im MLC-Labor wird die Funktion von Leukozyten mittels sensitiver Zellkulturverfahren [Lymphozytentransformationstest (LTT) und ELISpot] bestimmt. Beim LTT wird Zellproliferation gemessen, beim ELISpot die Zytokinsekretion, und zwar vorwiegend nach Stimulation mit mikrobiellen Antigenen. Zusätzlich werden Impfantikörper (Tetanus, Diphtherie) gemessen.
Einzuschickendes Untersuchungsmaterial
- LTT & ELISpot: 9 ml Heparinblut (blaue oder orange Monovette) – > Bitte beachten Sie Besonderheiten bei Kindern (s. LTT)
Besonderheit:
Die Proben für LTT, ELISpot und Phagozytosetest müssen spätestens 24 h nach Entnahme im Labor ankommen und bei Raumtemperatur gelagert werden. Blutentnahmen sollten montags bis donnerstags erfolgen. Das Blut muss spätestens donnerstags um 9.00 h im Labor sein. Bitte beachten Sie, dass ELISpots an 2 aufeinander folgenden Tagen bearbeitet werden.
- Diphtherie und Tetanus Toxoid-Antikörper: 5 ml Nativblut oder 2 ml Serum (weiße oder braune Monovette)
Kontakt
- Rückfragen zum LTT und ELISpot bitte unter 0201 723 4209
- Rückfragen zu Impfantikörpern bitte unter 0201 723 4208
Prinzip:
Der LTT-Test wird zur Abklärung von zellulären Immundefekten als auch zur Untersuchung der Immunkompetenz nach Transplantation angewendet. Der LTT dient der Überprüfung der T-Zellfunktion. Grund für die Untersuchung kann die Abklärung eines zellulären Immundefektes sowie ein Monitoring der zellulären Immunität nach Knochenmark- oder Stammzell-Transplantation oder bei HIV-Infektion sein. Insbesondere gehäufte Virusinfekte lassen eine Störung der Lymphozytenfunktion vermuten, so dass hier zur Abklärung ein LTT weiterhilft. Wir verwenden vier verschiedene Stimulanzien, und zwar die Mitogene Phythämagglutinin (PHA), Concanavalin A (ConA), Pokeweed-Mitogen (PWM) und anti-CD3 (OKT3). Die Proliferation der Lymphozyten wird in einer 4-Tage-Zellkultur gemessen.
Untersuchungsmaterial:
9 ml Heparinblut (blaue oder orange Monovette) bei Erwachsenen mit normaler Leukozytenzahl
Bei Kindern kann die Blutmenge in Abhängigkeit von der Lymphozytenzahl reduziert werden. Bei kleinen Kindern reichen meist 1-2 ml Blut.
Referenzwerte (Ergebnisse der entsprechenden LTTs sind angegeben als Counts per minute Inkrement, d.h. eine Negativkontrolle wurde subtrahiert):
- PHA: 92.000 – 167.000
- ConA: 33.000 – 76.000
- PWM: 9.000 – 29.000
- anti-CD3 (OKT3): 15.000 – 74.000
Bitte beachten Sie beim OKT, dass eine fehlende Reaktion bei sonst normalerer Mitogenreagibilität aufgrund einer genetischen Mutation auftreten kann und kein Hinweis auf eine Erkrankung ist.
Die Referenzwerte wurden von uns anhand von 387 gesunden Probanden etabliert.
Prinzip:
Der ELISpot (Enzyme-linked-immuno-Spot) Test ist ein extrem sensitives Verfahren, um Zellaktivierung auf Einzelzellniveau zu messen. Bei dieser Aktivierung werden Zytokine freigesetzt, die dann im ELISpot mittels monoklonaler Antikörper als farbige Punkte (Spots) sichtbar gemacht werden. Der Tuberkulose-ELISpot wurde zunächst bei uns in Studien evaluiert1,2 und steht seit Januar 2009 als diagnostisches Verfahren zur Verfügung (T-SPOT.TB, https://www.tspot.com/de/). Er misst Interferon-gamma produzierende T-Zellen als Immunreaktion gegenüber Bakterien des Mykobacterium tuberculosis-Komplexes (M. tuberculosis, M. africanum und M. bovis) und gegenüber M. leprae. Zur Tuberkulose-spezifischen Stimulation werden zwei Tuberkulose-spezifische Peptidmixe [6 kDa Early Secretory Antigenic target (ESAT-6) und Culture Filtrate Protein-10 (CFP-10)] eingesetzt.
Charakteristika:
Der ELISpot ergibt – im Gegensatz zum Tuberkulin-Hauttest – keine falsch positiven Reaktionen bei vorherigem Kontakt mit BCG-Impfstämmen sowie den meisten atypischen Mykobakterien (Ausnahmen: M. kansasii, M. szulgai, M. marinum, M. gastri und M. flavescens).
Er eignet sich besonders für die Untersuchung immunsupprimierter Patienten, da er im Vergleich zum Tuberkulin-Hauttest eine deutlich höhere Sensitivität und Spezifität (90 vs. 77% und 93 vs. 59%)3 aufweist.
Er misst Tuberkulose-Immunität innerhalb von einem Tag und reagiert positiv bei latenter und aktiver Tuberkulose.
Referenzwerte:
- ESAT-6: < 6 Spots Inkrement
- CFP-10: < 6 Spots Inkrement
Literatur:
- Lindemann M, Dioury Y , Beckebaum S, Cicinnati VR, Gerken G, Broelsch CE, Wrighton-Smith P, Grosse-Wilde H (2009): Tuberculosis immunity in patients awaiting liver transplantation. Hum Immunol 70, 24-28.
- Barsegian V, Mathias KD, Wrighton-Smith P, Grosse-Wilde H, Lindemann M (2008): Prevalence of latent tuberculosis infection in German radiologists. J Hosp Infect 69, 69-76.
- Pai M, Zwerling A, Menzies D (2008): Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med 149:177-184.
Prinzip:
Der ELISpot (Enzyme-linked-immuno-Spot) Test ist ein extrem sensitives Verfahren, um Zellaktivierung auf Einzelzellniveau zu messen. Bei dieser Aktivierung werden Zytokine freigesetzt, die dann im ELISpot mittels monoklonaler Antikörper als farbige Punkte (Spots) sichtbar gemacht werden. Der SARS-CoV-2 ELISpot wurde bei uns seit Mai 2021 etabliert und wird derzeit für die Diagnostik als CE-zertifizierter Test angeboten (T-SPOT.COVID, https://www.tspotcovid.com/). Er misst Interferon-gamma produzierende T-Zellen als Immunreaktion gegenüber Peptidmixen aus dem Spike Protein und dem Nukleokapsid von SARS-CoV-2.
Neben der spezifischen Antikörperantwort spielt auch die T-Zellantwort für das immunologische Gedächtnis bei einer SARS-CoV-2 Infektion eine wichtige Rolle. Wie kräftig die Immunantwort sein muss, um eine Infektion nach Impfung oder eine Reinfektion nach durchgemachter Infektion zu verhindern, ist derzeit allerdings unklar.
Charakteristika:
Man findet gegenüber den Spike Peptiden eine positive Reaktion nach SARS-CoV-2 Impfung und Infektion und gegenüber dem Nukleokapsid nur nach Infektion.
Referenzwerte (die das Fehlen einer Immunität anzeigen):
- SARS-CoV-2 Spike: < 6 Spots Inkrement
- SARS-CoV-2 Nukeokapsid: < 6 Spots Inkrement
Literatur: siehe Publikationen der Arbeitsgruppe seit 2021
In unserer Diagnostik wird der ELISpot wird nicht nur zum Nachweis Tuberkulose- und SARS-CoV-2-spezifischer T-Zellen verwendet, sondern – vor allem bei transplantierten Patienten – auch zum Nachweis der zellulären Immunität gegenüber Viren der Herpesgruppe und einem Polyomavirus:
- Zytomegalievirus (CMV)
- Varizella-Zoster-Virus (VZV)
- Epstein-Barr-Virus (EBV)
- BK-Virus (BKV)
Prinzip:
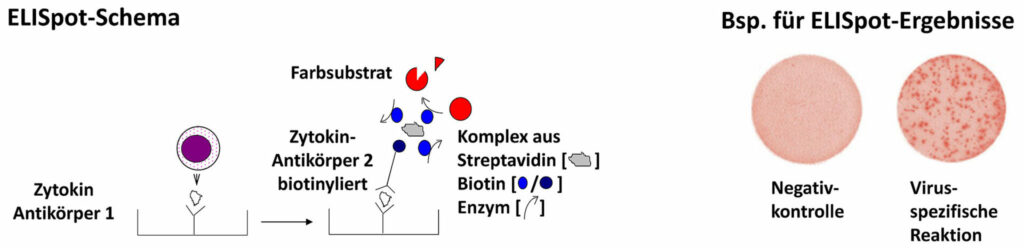
Der ELISpot (Enzyme-linked-immuno-Spot) Test ist ein extrem sensitives Verfahren, um Zellaktivierung auf Einzelzellniveau zu messen. Bei dieser Aktivierung werden u. a. Zytokine, lösliche Polypeptide oder Glykoproteine, die der Zellkommunikation dienen, freigesetzt. Die von Zellen freigesetzten Proteine werden beim ELISpot durch zwei monoklonale Zytokinantikörper detektiert, die unterschiedliche Epitope dieses Zytokins erkennen. Der eine der beiden Antikörper ist beim ELISpot an eine feste Phase gebunden, so dass es sich vom Prinzip her um einen Festphasen-ELISA handelt.
Neben seinem Einsatz bei diagnostischen Fragestellungen wird der ELISpot auch im Rahmen von Studien eingesetzt, bei denen eine genaue Quantifizierung von zellulären Reaktionen erfasst werden soll, etwa um einen Impferfolg zu messen. Im Falle der Influenza-Impfung könnten z. B. vor und nach Impfung Lymphozyten und Monozyten aus Blutproben von Probanden isoliert und in Zellkulturexperimenten mit Influenza-Proteinen stimuliert werden. Sollten die Influenza-Proteine von den Zellen erkannt werden, so werden Zytokine wie Interferon-gamma gebildet und können mit Hilfe des ELISpot als kleine Punkte (Spots) detektiert werden.
Untersuchungsmaterial:
Für die o.g. vier mikrobiellen Antigene sind jeweils 9 ml Heparinblut (blaue Monovette) nötig. Bei speziellen Fragestellungen kann sich die Menge auf bis zu 40 ml Heparinblut erhöhen.
- Gliga S, Korth J, Krawczyk J, Wilde B, Horn PA, Witzke O, Lindemann M*, Fiedler M* (2018): T-Track-CMV and QuantiFERON-CMV assays for prediction of protection from CMV reactivation in kidney transplant recipients. *equal contribution. J Clin Virol 105, 91-96.
- Lindemann M, Eiz-Vesper B, Steckel NK, Tischer S, Fiedler M, Heinold A, Klisanin V, Maecker-Kolhoff B, Blasczyk R, Horn PA, Beelen DW, Koldehoff M (2018): Adoptive transfer of cellular immunity against cytomegalovirus by virus-specific lymphocytes from a third party family donor. Bone Marrow Transplant 53(10), 1351-1355.
- Domouchtsidou A, Barsegian V, Mueller SP, Best J, Ertle J, Bedreli S, Horn PA, Bockisch A, Lindemann M (2018): Impaired lymphocyte function in patients with hepatic malignancies after selective internal radiotherapy. Cancer Immunol Immunother 67, 843-853.
- Kordelas L, da Silva Nardi F, Wagner B, Ditschkowski M, Liebregts T, Lindemann M, Heinemann FM, Horn PA, Beelen DW, Rebmann V (2018): Elevated soluble Human Leukocyte Antigen G levels in patients after allogeneic stem cell transplantation are associated with less severe acute and chronic graft-versus-host disease. Bone Marrow Transplant. 53(9), 1149-1156.
- Banas B, Chittka D, Banas MC., Steubl D, Renders L, Wekerle T, Koch M, Witzke O, Mühlfeld A, Sommerer C, Habicht A, Hugo C, Hünig T, Lindemann M, Schmidt T, Rascle A, Barabas S, Deml L, Wagner R, Krüger B, Krämer BK (2018): Clinical validation of T-Track® CMV to monitor CMV-specific cell-mediated immunity in kidney transplant recipients. Transpl Int 31, 436-450.
- Koldehoff M, Lindemann M, Ross SR, Elmaagacli AH (2018): Cytomegalovirus induces HLA-class-II-restricted alloreactivity in an acute myeloid leukemia cell line. PLoS ONE 13(1): e0191482.
- Danielzik T, Koldehoff M, Buttkereit U, Beelen DW, Horn PA, Lindemann M (2018): Sensitive detection of rare antigen specific T cells directed against Wilms’ tumor 1 by FluoroSpot assay. Leukemia & Lymphoma 59(2), 490-492.
- Kordelas L, Buttkereit U, Lindemann M, Koldehoff M, Klisanin V, Horn PA, Fleischhauer K, Dietrich W. Beelen DW (2017): αβ-T-cell depleted donor lymphocyte infusion for leukemia relapse after allogeneic stem cell transplantation. Bone Marrow Transplant 52(12), 1668-1670.
- Lindemann M, Zaslavskaya M, Fiedler M, Wilde B, Heinemann FM, Heinold A, Horn PA, Witzke O (2017): Humoral and cellular responses to a single dose of Fendrix in renal transplant recipients with non-response to conventional hepatitis B vaccination. Scand J Immunol 85(1), 51-57.
- Barsegian V, Müller SP, Möckel D, Horn PA, Bockisch A, Lindemann M (2017): Lymphocyte function following radium-223 therapy in patients with metastasized, castration resistant prostate cancer. Eur J Nucl Med Mol Imaging 44(2), 242-246.
- Luckau S, Wehrs TP, Brandau S, Horn PA, Lindemann M (2016): Vaccination against human papilloma viruses leads to a favorable cytokine profile of specific T cells. J Immunother 39(8), 316-320.
- Lindemann M, Könemann J, Horn PA, Witzke O (2016): IL-17 ELISpot as predictor for kidney allograft rejection? Clin Lab 62(5), 963-965.
- Lindemann M, Fiedler M, Schumann A, Koldehoff M, Ottinger HD, Heinemann FM, Roggendorf M, Horn PA, Beelen DW (2016): Control of hepatitis B virus infection in hematopoietic stem cell recipients after receiving grafts from vaccinated donors. Bone Marrow Transplant 51(3), 428-431.
- Barsegian V, Hueben C, Mueller SP, Poeppel TD, Horn PA, Bockisch A, Lindemann M (2015): Impairment of lymphocyte function following Yttrium-90 DOTATOC therapy. Cancer Immunol Immunother 64(6), 755-764.
- Seifert M, Przekopowitz M, Sarah Taudien S, Lollies A, Ronge V, Drees B, Lindemann M, Hillen U, Engler H, Singer BB, Kueppers R (2015): Functional capacities of human IgM memory B cells in early inflammatory responses and secondary germinal center reactions. P Natl Acad Sci USA 112(6), E546-55.
- Lindemann M (2014): Ex vivo assessment of cellular immune function – applications in patient care and clinical studies. Tissue Antigens 84, 439-449.
- Krawczyk A, Ludwig C, Jochum C, Fiedler M, Heinemann FM, Shouval D, Roggendorf M, Roggendorf H, Lindemann M (2014): Induction of a robust T- and B-cell immune response in non- and low-responders to conventional vaccination against hepatitis B by using a third generation PreS/S vaccine. Vaccine 32, 5077-5082.
- Krawczyk A, Roggendorf H, Ludwig C, Herzer K, Gerken G, Horn PA, Roggendorf M, Lindemann M (2013): Therapeutic vaccination of a liver transplant recipient who suffered from fulminant hepatitis B during pregnancy. Liver Transplant 19, 1411-1412.
- Pajtler KW, Rebmann V, Lindemann M, Schulte JM, Schulte S, Stauder M, Leuschner I, Schmid KW, Köhl U, Schramm A, Eggert A (2013): Expression of TrkA affects immunogenicity of neuroblastoma cells. Int J Cancer 133, 908-919.
- Esser S, Jablonka R, Heinemann FM, Reuter S, Jaeger H, Von Krosigk A, Schenk-Westkamp P, Schadendorf D, Horn PA, Lindemann M (2012): Detection of abacavir hypersensitivity by ELISpot method. Inflamm Allergy Drug Targets 11, 227-234.
- Barsegian V, Müller S, Horn PA, Bockisch A, Lindemann M (2011): Lymphocyte function following radioiodine therapy in patients with thyroid carcinoma. Nuclear Medicine 50, 195-203.
- Lindemann M, Saure C, Klinkenbusch H, Valentin-Gamazo C, Horn PA, Cicinnati VR, Beckebaum S, Witzke O (2011): Alloreactivity in recipients prior to and post living kidney and liver transplantation. Scand J Immunol 73, 344-345.
- Schumann A, Lindemann M, Valentin-Gamazo C, Lu M, Elmaagacli A, Dahmen U, Knop D, Broelsch CE, Grosse-Wilde H, Roggendorf M, Fiedler M (2009): Adoptive immune transfer of hepatitis B virus specific immunity from immunized living liver donors to liver recipients. Transplantation 87, 103-111.
- Schumann A, Fiedler M, Dahmen U, Grosse-Wilde H, Roggendorf M, Lindemann M (2007): Cellular and humoral immune response to a third generation hepatitis B vaccine. J Viral Hepatitis 14, 592-598.
- Lindemann M, Witzke O, Lütkes P, Fiedler M, Kreuzfelder E, Philipp T, Roggendorf M, Grosse-Wilde H (2006): ELISpot assay as a sensitive tool to detect cellular immunity following influenza vaccination in kidney transplant recipients. Clin Immunol 120, 324-328.
- Rebmann V, Busemann A, Lindemann M, Grosse-Wilde H (2003): Detection of HLA-G5 secreting cells. Human Immunol 64, 1017-1024.
Bedeutung und Prinzip:
Die Bestimmung dieser Antikörper dient der Überprüfung eines Impfschutzes, und zwar insbesondere bei Patienten mit verminderter Immunkompetenz wie Transplantat-Empfängern.
Die Bestimmung der Antikörper der Klasse IgG erfolgt mittels ELISA-Verfahren (Diphtherie ELISA und Tetanus ELISA). Für die Bestimmung von IgG Antikörpern gegen Diphtherie und Tetanus Toxoid ist ein INSTAND-Ringversuch verfügbar, an dem wir regelmäßig erfolgreich teilnehmen.
Die Teste werden gemäß Herstellerangabe durchgeführt, Sie können anbei detaillierte Beschreibungen als PDF Dokumente aufrufen:
Referenzwerte:
- Diphtherie Impfschutz ausreichend: >0,1 U/ml
- Tetanus Impfschutz ausreichend: >0,5 U/m
Ansprechpartnerinnen:
Gabriela Graf
MTLA
Jessica Wunderling
BTA
Birgit Thiam
MTLA


