
FCM-Labor
Im FCM-Labor wird im Rahmen der Lebend-Nierentransplantation ein durchflusszytometrisches Crossmatch durchgeführt. Ferner werden Leukozyten-Subpopulationen bestimmt.
Einzuschickendes Untersuchungsmaterial
Durchflusszytometrisches Crossmatch:
- Empfänger: 9 ml Nativblut (weiße oder braune Monovette) + 18 ml Heparinblut (2 blaue Monovetten)
- Spender: 18 ml Heparinblut (2 blaue Monovetten)
Leukozyten-Differenzierung:
- 2,7 ml EDTA-Blut (kleine rote Monovette)
Kontakt
Rückfragen bitte unter 0201 723 4227
Bedeutung und Prinzip:
Patienten vor Organtransplantation können Alloantikörper entwickeln, die häufig gegen HLA-Antigene gerichtet sind. Diese Alloimmunisierung kann durch Bluttransfusionen, vorherige Transplantationen oder Schwangerschaften erfolgen. Die übliche Methode, diese HLA-spezifischen Antikörper nachzuweisen, ist die sogenannte lymphozytotoxische Verträglichkeitsprüfung (Kreuzprobe) mittels Lymphocyte Cytotoxicity Test (LCT) von Spender-Lymphozyten und einer aktuellen Serumprobe vor Organtransplantation des Patienten. Neben diesem Verfahren hat sich auch die durchflusszytometrische Kreuzprobe (FCXM) bewährt, die eine höhere Sensitivität gegenüber dem LCT aufweist. Im FCXM werden zusätzlich zu den lymphozytotoxischen Antikörpern, deren Reaktion komplementabhängig ist, auch Antikörper solcher Immunglobulin-Klassen erfasst, die kein Komplement binden (IgG2 und IgG4).
Da verfahrensbedingt im FCXM nur eine Bindung von Spenderzell-spezifischen Antikörpern nachgewiesen werden kann, besteht keine Möglichkeit, eine Aussage über die HLA-Spezifität der untersuchten Antikörper zu machen.
Eine Kreuzproben-Testung mittels Durchflusszytometrie wird im Rahmen der Lebend-Organtransplantation zur weiteren Absicherung des im LCT ermittelten Ergebnisses durchgeführt. Die FCXM-Testung erfolgt bei CD3+ T-Lymphozyten und CD19+ B-Lymphozyten.
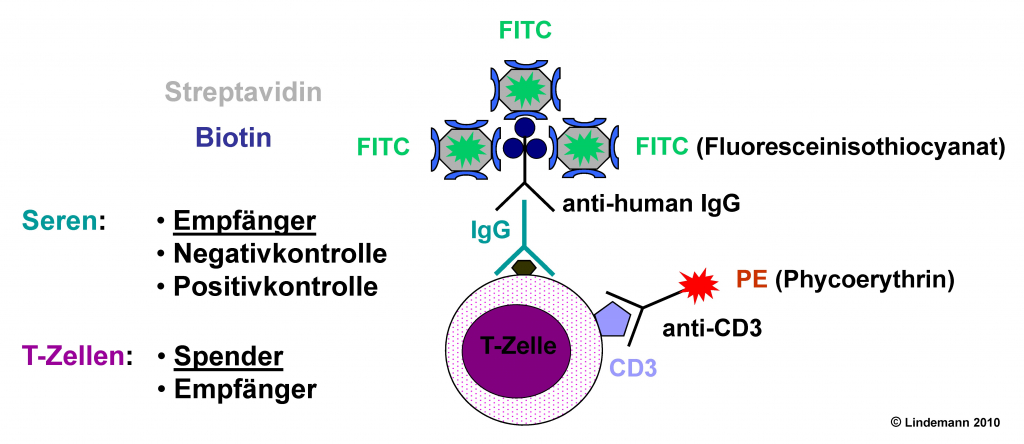
In mittels Ficoll isolierten mononukleären Zellen sind die für den Verlauf nach Transplantation wichtigen immunkompetenten Zellen (CD3+ T-, CD19+ B-Lymphozyten) vorhanden, die an entsprechende Alloantikörper binden. Zum Nachweis der IgG-Antikörper werden im ersten Schritt die Lymphozyten des Organspenders mit dem Serum des Empfängers inkubiert. Im zweiten Schritt wird für CD3+ T-Lymphozyten ein anti-IgG (human) Antikörper hinzugegeben, der mit Biotin markiert ist. Der Nachweis der gebundenen IgG-Antikörper erfolgt mit Fluoresceinisothiocyanat (FITC)-markiertem Streptavidin.
Mit dem linienspezifischen monoklonalen Antikörper (moAK) anti-CD3 (PE-markiert) werden in einer abschließenden Inkubation die T-Lymphozyten markiert. Eine ähnliche Analyse erfolgt auch für CD19+ B-Lymphozyten. Die Streulicht- und Fluoreszenz-Messungen werden anschließend mit dem Durchflusszytometer FACSCalibur durchgeführt, bei der Auswertung wird die CellQuest Pro-Software eingesetzt. Bei der Fluoreszensmessung des FITC ist die mediane Fluoreszensintensität (MFI) die wichtige Messgröße für die Anwesenheit von IgG-Antikörpern.
FCXM Schema:
Referenzwerte:
Anhand einer Diskriminations- und Receiver Operating Curve (ROC)-Analyse von 164 T-Zell FCXM Ergebnissen und den zugehörigen Daten zur Abstoßung nach NTX wurden positive Reaktionen folgendermaßen definiert und der Grenzwert anhand von UK Neqas Ringversuchen validiert:
- Gemessener Wert > Mediane Fluoreszenzintensität (MFI) der Negativkontrolle + 22
- Anhand der Ergebnisse der UK Neqas Ringversuche wurde für das B-Zell FCXM eine positive Reaktion so definiert:
- Gemessener Wert > Mediane Fluoreszenzintensität (MFI) der Negativkontrolle + 25,5
Literatur:
- Lindemann M, Heinold A, Lenz V, Horn PA, Heinemann FM (2017): The flow cytometric crossmatch – a moresensitive prediction of transplant rejections. Transfus Med 7, 233-237.
- Lindemann M, Lenz V, Nyadu B, Heinemann FM, Heinold A, Guberina H, Eisenberger U, Lachmann N, Schönemann C, Kribben A, Paul A, Horn PA, Witzke O (2016): Effect of ABO incompatibility on T cell flow cytometry crossmatch results prior to living donor kidney transplantation. Cytometry B Clin Cytom Nov 18.
- Lindemann M, Nyadu B, Heinemann FM, Kribben A, Paul A, Horn PA, Witzke O (2010): High negative predictive value of an amplified flow cytometry crossmatch prior to living donor kidney transplantation. Hum Immunol 71, 771-776.
Bedeutung und Prinzip:
Zur Abklärung angeborener oder erworbener Immundefekte, z. B. nach hämatopoietischer Blutstammzell-Transplantation, können Lymphozyten-Differenzierungsmarker untersucht werden. Beispielsweise ist innerhalb des ersten Jahres nach Transplantation häufig eine verminderte Zahl von Helfer T-Zellen (CD3+ CD4+) zu beobachten. Bei der Lymphozyten-Differenzierung werden als Marker für T-Zellen CD3, CD4 und CD8, für B-Zellen CD19 und für NK-Zellen CD3, CD16 und CD56 eingesetzt. Bei der Testung wird EDTA-Blut lysiert und danach direkt mit den Antikörpern gegen Zelloberflächenmarker inkubiert. Die Messung erfolgt am FACSLyric und die Auswertung mittels BD FACSuite™ Software.
Referenzwert:
wird abhängig vom Alter beim Befund mit angegeben
Bärbel Nyadu
